El atomo
El átomo es la unidad de materia más pequeña de un elemento químico que mantiene su identidad o sus propiedades, y que no es posible dividir mediante proceso químico.

visión historica
Los filósofos griegos discutieron mucho sobre la naturaleza de la materia y concluyeron que el mundo era más sencillo de lo que parecía.
En el siglo V a.C., Leucipo pensaba que sólo había un tipo de materia. Sostenía, además, que si dividíamos la materia en partes cada vez más pequeñas, acabaríamos encontrando una porción que no se podría seguir dividiendo. Un discípulo suyo, Demócrito, bautizó a estas partes indivisibles de materia con el nombre de átomos, término que en griego significa “que no se puede dividir”.
Empédocles estableció que la materia estaba formada por 4 elementos: tierra, agua, aire y fuego.
Aristóteles negó la existencia de los átomos de Demócrito y reconoció la teoría de los 4 elementos, que, gracias al prestigio que tenía, se mantuvo vigente en el pensamiento de la humanidad durante 2000 años. Hoy sabemos que aquellos 4 elementos iniciales no forman parte de los 106 elementos químicos actuales.
teoria atomica de dalton
En 1808, John Dalton publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y Demócrito. Según la teoría de Dalton:
1) Los elementos están formados por partículas discretas, diminutas e indivisibles, llamadas átomos, que no se alteran en los cambios químicos.
2) Los átomos de un mismo elemento son todos iguales entre sí en masa, tamaño y en el resto de las propiedades físicas o químicas. Por el contrario, los átomos de elementos diferentes tienen distinta masa y propiedades.
3) Los compuestos se forman por la unión de átomos de los correspondientes elementos según una relación numérica sencilla y constante. Por ejemplo, el agua está formada por 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno.
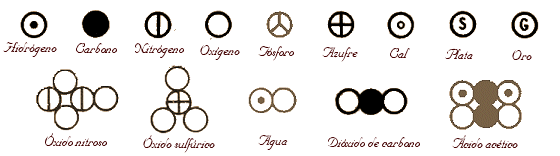
Símbolos usados por Dalton para representar a los elementos
Hoy sabemos que ninguno de estos tres puntos es completamente cierto; sin embargo, Dalton contribuyó enormemente a entender cómo estaba formada la materia.
|
|
El átomo y sus partículas subatomicas
Es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas
Estructura atómica
El átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleones, alrededor del cual se encuentra una nube de electrones de carga negativa.
Partículas subatómicas
Una vez aceptada la teoría atómica de la materia, los fenómenos de electrización y electrólisis pusieron de manifiesto, por un lado, la naturaleza eléctrica de la materia y, por otro, que el átomo era divisible, es decir, que estaba formado por partículas más pequeñas que el propio átomo.
Los fenómenos eléctricos son una manifestación de su carga eléctrica.
Del mismo modo que existen 2 tipos de fenómenos eléctricos (atracción y repulsión), se admite que las propiedades que poseen los cuerpos electrizados se deben a la presencia en ellos de 2 tipos de cargas eléctricas denominadas, de forma arbitraria, negativa y positiva.
Dos cuerpos que hayan adquirido una carga del mismo tipo se repelen, mientras que si poseen carga de distinto tipo se atraen.
En general, la materia es eléctricamente neutra, es decir, tiene la misma cantidad de cada tipo de carga. Cuando adquiere carga, tanto positiva como negativa, es porque tiene más cantidad de un tipo que de otro.
Electrón
Al estudiar los fenómenos eléctricos se llegó a la conclusión de que la teoría de Dalton era errónea y, por tanto, debían existir partículas más pequeñas que el átomo, que serían las responsables del comportamiento eléctrico de la materia.
En 1897, el físico británico J. J. Thomson realizó experiencias en tubos de descarga de gases, que eran tubos de vidrio que contenían un gas a muy baja presión y un polo positivo (ánodo) y otro negativo (cátodo) por donde se hacía pasar una corriente eléctrica con un elevado voltaje.
Thomson observó que se emitían unos rayos desde el polo negativo hacia el positivo, los llamó rayos catódicos.
Al estudiar las partículas que formaban estos rayos se observó que eran las mismas siempre, cualquiera que fuese el gas del interior del tubo. Por ello se dedujo que en el interior de todos los átomos existen una ó más partículas con carga negativa y se les dio el nombre de electrones.
En esta escena se puede ver una representación esquemática del experimento realizado con el tubo de descarga de gases
Protón
En 1886, el físico alemán E. Goldstein realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre de rayos canales.
El estudio de estos rayos determinó que estaban formados por partículas de carga positiva y que tenían una masa distinta según cual fuera el gas que estaba encerrado en el tubo. Esto aclaró que las partículas salían del seno del gas y no del electrodo positivo.
Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva oprotón, cuya carga es la misma que la del electrón pero positiva y su masa es 1837 veces mayor.
En la siguiente escena puede verse el experimento en el cual se descubrieron los rayos canales:
Neutrón
Mediante diversos experimentos se comprobó que la masa de protones y electrones no coincidía con la masa total del átomo; por tanto, Rutherford supuso que tenía que haber otro tipo de partícula subatómica en el núcleo de los átomos.
Estas partículas se descubrieron en 1932 por J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones. El hecho de no tener carga eléctrica hizo muy difícil su descubrimiento.
Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.
|
Partículas elementales
|
| |
Masa
|
Carga
|
| Electrón (e-) |
1/1837 uma
|
Negativa
|
| Protón (p+) |
1 uma
|
Positiva
|
| Neutrón (n) |
1 uma
|
Sin carga
|
|
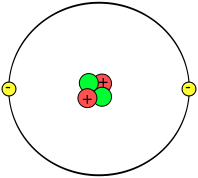
Modelo atómico de Thomsom
Al ser tan pequeña la masa de los electrones, el físico inglés J.J.Thomson propuso, en 1904, que la mayor parte de la masa del átomo correspondería a la carga positiva, que ocuparía la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones, más o menos como las uvas pasas en un pudin.
En esta escena se puede observar cómo sería un átomo con este modelo:
Este modelo del “pudin de pasas” de Thomson era bastante razonable y fue aceptado durante varios años, ya que explicaba varios fenómenos, por ejemplo los rayos catódicos y los canales:
Experimento de Rutherford
En 1911, el físico y químico Ernest Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (positivas), procedentes de un material radiactivo, a gran velocidad. El experimento permitió observar el siguiente comportamiento en las partículas lanzadas:
La mayor parte de ellas atravesaron la lámina sin cambiar de dirección, como era de esperar.
Algunas se desviaron considerablemente.
Unas pocas partículas rebotaron hacia la fuente de emisión.
En esta escena se pueden ver los detalles del experimento
El comportamiento de las partículas no podía ser explicado con el modelo de Thomson, así que Rutherford lo abandonó y sugirió otro basado en el átomo nuclear.
Modelo de Thomson: De acuerdo con este modelo, en el cual la carga positiva de cada átomo está distribuida de forma homogénea, las partículas positivas que atraviesan la lámina no deberían ser apreciablemente desviadas de su trayectoria inicial. Evidentemente, esto no ocurría.
Modelo de Rutherford: La carga positiva está concentrada en un núcleo central, de manera que las partículas positivas que pasan muy cerca de él se desvían bastante de su trayectoria inicial y sólo aquellas pocas que chocan directamente con el núcleo regresan en la dirección de la que proceden.
En esta escena se puede observar lo que tenía que haber ocurrido con cada uno de estos modelos, el de Thomson (que dejó de ser válido) y el nuevo propuesto por Rutherford:
Modelo atómico de Rutherford
El Modelo de Rutherford establecía:
El átomo tiene un núcleo central en el que están concentradas la carga positiva y prácticamente toda la masa.
La carga positiva de los protones es compensada con la carga negativa de los electrones, que se hallan fuera del núcleo. El núcleo contiene, por tanto, protones en un número igual al de electrones del átomo.
Los electrones giran a gran velocidad alrededor del núcleo y están separados de éste por una gran distancia.
Rutherford supuso que el átomo estaba formado por un espacio fundamentalmente vacío, ocupado por electrones que giran alrededor de un núcleo central muy denso y pequeño.
En la siguiente escena se puede ver el Modelo de Rutherford para átomos de los 5 primeros elementos de la tabla periódica:
El átomo queda constituido por:
Una zona central o núcleo donde se encuentra la carga total positiva (la de los protones) y la mayor parte de la masa del átomo, aportada por los protones y neutrones.
Una zona externa o corteza donde se hallan los electrones, que giran alrededor del núcleo.
Hay tantos electrones en la corteza como protones en el núcleo, por lo que el conjunto del átomo es eléctricamente neutro.
Modelo atómico de Bohr
El físico danés Niels Bohr realizó una serie de estudios de los que dedujo que los electrones de la corteza giran alrededor del núcleo describiendo sólo determinadas órbitas circulares.
En el átomo, los electrones se organizan en capas y, en cada capa tendrán una cierta energía, llenando siempre las capas inferiores y después las superiores.
En la siguiente escena puede observarse la representación de los átomos de los 12 primeros elementos de la tabla periódica con este modelo:
La distribución de los electrones en las capas se denomina configuración electrónica y se realiza de la siguiente manera:
La 1ª capa puede contener, como máximo, 2 electrones.
La 2ª capa puede contener, como máximo, 8 electrones. Comienza a llenarse una vez que la 1ª ya está completa.
La 3ª capa puede contener, como máximo, 18 electrones. Comienza a llenarse una vez que la 2ª capa ya está completa.
Se representa por números separados por comas y entre paréntesis. Por ejemplo, el átomo de sodio tiene 11 electrones; por tanto, 2 llenan la 1ª capa, 8 quedan en la 2ª capa y el último electrón quedaría en la 3ª capa. La representación es: (2,8,1).
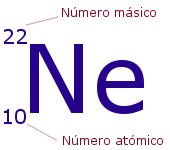
El numero atómico y el numero másico
La identidad de un átomo y sus propiedades vienen dadas por el número de partículas que contiene. Lo que distingue a unos elementos químicos de otros es el número de protones que tienen sus átomos en el núcleo. Este número se llama Número atómico y se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento Hidrógeno tienen 1 protón y su Z = 1, los de helio tienen 2 protones y Z =2, los de litio, 3 protones y Z = 3,…
Si el átomo es neutro, el número de electrones coincide con el de protones y nos lo da Z.
El Número másico nos indica el número total de partículas que hay en el núcleo, es decir, la suma de protones y neutrones. Se representa con la letra A y se sitúa como superíndice a la izquierda del símbolo del elemento. Representa la masa del átomo medida en uma, ya que la de los electrones es tan pequeña que puede despreciarse.
En el ejemplo, tendríamos un átomo del elemento neón, con 10 protones en su núcleo y 10 electrones en su corteza (es neutro). Tendría también: 22-10 = 12 neutrones.
Representación de Iones
Un ion se representa mediante el símbolo del elemento del que procede, con un superíndice a la derecha, que indica la carga que posee mediante un número y el signo + o el signo -.
Los cationes han perdido electrones en el número que indica la carga positiva. Por ejemplo, +3 indicará que ese átomo ha perdido 3 electrones.
Los aniones han ganado electrones, en el número que indica la carga negativa. Por ejemplo, -2 indicará que ese átomo ha ganado 2 electrones.
En esta escena puedes determinar las distintas partículas subatómicas de una especie atómica
Este átomo corresponde al elemento Aluminio. Tiene 13 protones y 14 neutrones. Es un catión con carga +3, lo que quiere decir que ha perdido 3 electrones respecto a su estado neutro; por tanto, tiene 13-3 = 10 electrones.
Isotopos
Todos los átomos de un elemento químico tienen el mismo número de protones, pero pueden diferenciarse en el número de neutrones.
Se llaman Isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A).
Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones.
Para nombrarlos se indica su nombre seguido de su número másico; por ejemplo, sodio-23 (Na-23
Masa atómica
La mayoría de los elementos químicos presentan isótopos. Cuando hablamos de la masa atómica de un elemento químico, nos referimos a la masa de un átomo “medio” de ese elemento. Para calcularla, tendremos que tener en cuenta la masa de cada isótopo y su abundancia en la naturaleza.
Ejercicios sobre el atomo
La tabla periódica
|
 |
A lo largo del siglo XIX aumentó espectacularmente el número de los elementos químicos conocidos. Se comprobó, además, que entre algunos elementos existían notables semejanzas en sus propiedades químicas y físicas. Ante este hecho, y con objeto de presentar de modo racional los conocimientos de la Química, se creyó que podría ser muy útil ordenar los elementos de algún modo que reflejase las relaciones existentes entre ellos.
Tras varios intentos, en 1869 el químico ruso D. Mendeleiev presentó una tabla en la que aparecían los elementos distribuidos en filas y columnas, agrupados ordenadamente en diversas familias, siguiendo un orden creciente de masas atómicas.
En la actualidad esta tabla aparece bastante modificada, ya que se ordenan los elementos por orden creciente de número atómico. Dicha tabla, a la que llamamos Tabla Periódica o Sistema Periódico, es una expresión de las relaciones que existen entre los elementos químicos. Por eso, favorece su estudio y nos permite deducir muchas de sus propiedades con sólo saber su situación en ella.
Las 7 filas horizontales reciben el nombre de períodos y las 18 filas verticales o columnas se llamangrupos. Algunos de estos grupos tienen nombres especiales; así ocurre con el 16, los calcógenos(O,S,Se,Te); el 17, los halógenos (F,Cl,Br,I), o el 18, los gases nobles (He,Ne, Ar,...). |
|
|
|
|
|
|

|
|